近日,广东工业大学环境健康与污染控制研究院、环境科学与工程学院安太成教授团队与华东师范大学武冬研究员合作,在城市气载耐药基因研究方面取得新进展,成果以《Metagenomic and Machine Learning Meta-Analyses Characterize Airborne Resistome Features and Their Hosts in China Megacities》为题发表在Environmental Science & Technology期刊上(2023, 57(43):16414-16423)。论文的第一作者为华东师范大学武冬研究员,通讯作者为安太成教授。本论文的研究目的在于探索是否可以通过机器学习分类的方法,识别城市空气环境ARGs的不同排放位点的特征,并基于ARGs宿主对微生物群落的生态优势,分析了潜在致病菌对耐药性特征形成的重要性。研究结果显示了污染源排放和人类病原菌极大地影响了气载ARGs特征的形成,机器学习所识别出的特征耐药ARGs组分,可以为更准确地制定大气生物耐药性风险评估与防控策略提供了抓手与技术支持。

论文网址: https://pubs.acs.org/doi/10.1021/acs.est.3c02593
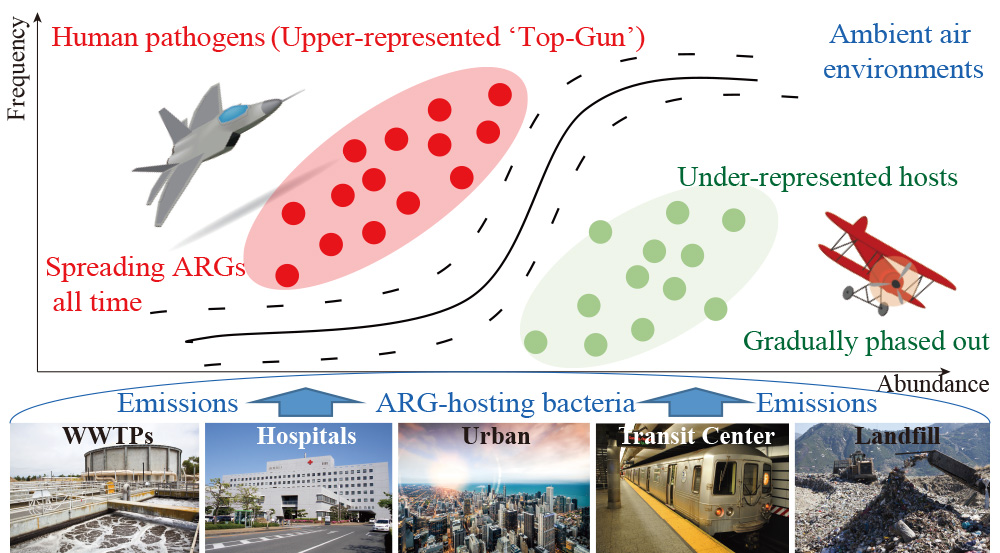
大型城市空气中含有各种人类活动场所排放的抗生素耐药基因(ARGs)。然而城市大气中ARGs是否表现出排放位点的特异性、其致病性宿主菌群能否长期存在于空气中,均是大气耐药性研究领域未知的科学问题。本文首先选择了来自中国7个特大城市的医院、城市污水处理厂和垃圾填埋场、公共交通中心和城市场所的空气中ARGs的数据作为研究对象,共检索1.2Tb宏基因组序列(n = 136)。经deep-ARG标准化统一流程分析后,获得百余个大气样品的抗生素耐药组数据,再利用随机森林(RF)、支持向量机(SVM)、梯度提升树(GBT)在内的多种算法进行机器学习分类和优化验证,识别了不同城市排放点位的特征ARGs;并利用宏基因组分箱、耐药基因序列比对等手段,甄别出了ARGs的微生物宿主。研究发现ARGs的排放位点特异性在医院空气中最为明显,可产生对临床常用的利福霉素和糖肽抗生素的耐药性;而磺胺和四环素类ARGs则在自然环境空气中更具有特异性。此外,含有特征耐药性ARGs的宏基因组组装基因组(MAGs)大部分为病原微生物,其在气载微生物群落中占据了优势生态位(P < 0.01, m = 0.22 – 0.50, R2 = 0.41 – 0.86),这在一定程度上突显了城市空气中持久的抗生素耐药危害。研究工作首次证明了机器学习分类能有效解析大气中ARGs的来源,并揭示出气载ARGs组成特征的形成机制。相关成果可以为精准制定大气耐药性风险评估防控策略提供一定的技术与理论保障。
该论文曾受ES&T编辑部邀请做封面投稿,展示如下:

图文摘要
英文摘要
Urban ambient air contains a cocktail of antibiotic resistance genes (ARGs) emitted from various anthropogenic sites. However, what is largely unknown is whether the airborne ARGs exhibit site-specificity or their pathogenic hosts persistently exist in the air. Here, by retrieving 1.2Tb metagenomic sequences (n = 136), we examined the airborne ARGs from hospitals, municipal wastewater treatment plants (WWTPs) and landfills, public transit centers, and urban sites located in seven of China’s megacities. As validated by the multiple machine learning-based classification and optimization, ARGs’ site-specificity was found to be the most apparent in the hospital air, with featured resistances to clinical-used rifamycin and (glyco)peptides, whereas the more environmentally prevalent ARGs (e.g., resistance to sulfonamide and tetracycline) were identified being more specific to the nonclinical ambient air settings. Nearly all metagenome-assembled genomes (MAGs) that possessed the site-featured resistances were identified as pathogenic taxa, which occupied the upper-representative niches in all the neutrally distributed airborne microbial community (P < 0.01, m = 0.22 – 0.50, R2 = 0.41 – 0.86). These niche-favored putative resistant pathogens highlighted the enduring antibiotic resistance hazards in the studied urban air. These findings are critical, albeit the least appreciated until our study, to gauge the airborne dimension of resistomes’ features and fates in urban atmospheric environments.
项目资助:
本研究得到了国家自然科学基金(42377425、42107457、U1901210和42007393)、贵州医科大学环境污染监测与疾病控制教育部重点实验室(KY2022383)和广东工业大学污染物暴露与健康粤港澳联合实验室(GHMJLCEH-12)的资助。香港研究资助局(25210420、15213922和15210618)、重庆市国家自然科学基金(CSTB2023NSCQ-MSX0157)和教育部万人计划(202211070036)的资金支持。